


















公司网址:www.www.wagawa.com
厂家服务热线:0903-6682528
全国服务热线:400-966-8288
公司地址:新疆和田洛浦县杭桂路232号
摘要 目的:探讨肉苁蓉总苷( GCs)对阿尔茨海默病(AD)模型大鼠学习认知功能的影响及其作用机制。方法:双侧脑室注射Aβ1-42 制备AD大鼠模型,连续给予模型大鼠不同剂量的GCs 腹腔注射20 d,Morris 水迷宫检测各组大鼠空间学习记忆能力,尼氏染色观察海马CA1区细胞形态并计数正常锥体细胞;免疫组织化学测定脑组织突触素( SYN)含量、酶联免疫吸附试验测定血清超氧化物歧化酶( SOD)和谷胱甘肽过氧化物酶( GSH-Px)活性、丙二醛( MDA)的含量。结果:GCs 可明显缩短逃避潜伏期与上台前路程,明显增加目标象限时间百分比与穿越平台次数;GCs 能提高海马CA1区锥体细胞的存活率,明显增加SYN蛋白的表达和提高SOD、GSH-Px 活
性,降低MDA的活性。结论:GCs 改善AD学习认知障碍的机制可能是通过减少自由基堆积、清除体内过多的过氧化物,进而提高突触可塑性来改善学习认知功能。
关键词 肉苁蓉总苷;阿尔茨海默病;突触可塑性;自由基;大鼠
阿尔茨海默病( Alzheimer’s disease,AD)是发生在老年前期或老年期的一种慢性中枢神经系统退行性疾病;以进行性记忆减退、认知功能障碍及心理精神状态改变为主要临床表现[1] ;以大脑皮质萎缩、突触神经元丢失、老年斑( senileplaques,SP)沉积及神经原纤维缠结( neurofibrillarytangles,NFT)为主要病理改变[2],关于其发病机制目前尚不明确。肉苁蓉( cistanch)为列当科植物,药效广泛,素有“沙漠人参”之美誉。肉苁蓉总苷( glycosides of cistanche,GCs)是肉苁蓉的主要提取物,包括苯乙醇苷类、环烯醚萜类、挥发性成分、木脂素类、多糖、生物碱等。研究显示,GCs 具有改善AD相关学习认知功能障碍的药理作用[3-4] ;但关于GCs 改善学习认知的具体机制仍无定论,故研究GCs 对AD模型大鼠学习认知功能的影响,并探讨其作用机制,以期为临床治疗AD提
供实验依据。
1 材料和方法
1.1 实验动物及分组
雄性6 月龄Wistar 大鼠70 只( 购自内蒙古大学动物实验中心),饲养于清洁级环境,自由进食进水。将动物随机分为以下7 组(10 只/ 组):空白对照组( Control)、溶剂对照组( Vehicle)、假手术组( Sham)、模型组( Model)、肉苁蓉总苷低剂量组(25 mg·kg-1·d-1)、中剂量组(50 mg·kg-1·d-1)、高剂量组(100 mg·kg-1·d-1)。空白对照组不给予任何处理;假手术组只进行侧脑室插管,但无液体注射;溶剂对照组侧脑室给予与模型组等体积的灭菌水;模型组给予双侧脑室可溶性Aβ1-42 寡聚体注射( 每侧10 μg);给药组给予模型动物肉苁蓉总苷对应剂量,肉苁蓉总苷用灭菌水进行溶解,调整药液浓度,保证各组给药体积相同。动物通过灌胃给
药,灌胃给药1 次/ 日,连续给药20 d。
1.2 AD动物模型制备
1.2.1 可溶性Aβ1-42 寡聚体的制备
具体制备过程详见贾建新等[5]相关报道。将Aβ1-42粉末溶解于预冷的六氟异丙醇至浓度为1 mmol/L,而后分装到无菌微量离心管内。留取10 μL作为聚合对照。用冷冻抽干机在真空条件下将Aβ溶液抽干后-80℃保存备用。聚合过程中先将抽干后的Aβ用二甲基亚砜溶解至5 mmol/L,再用预冷的F-12/DMEM培养基稀释至200 μmol/L,4℃孵育24 h。4℃,14 000 r/min离心5 min,上清即为可溶性Aβ1-42寡聚体,将上清转移至新的EP管,4℃保存,去除离心管下方不溶的寡聚体。可溶性Aβ1-42寡聚体用前使用无菌PBS稀释至所用浓度(2 μg/μL)。
1.2.2 双侧侧脑室可溶性Aβ1-42 寡聚体注射 大鼠经2 % 戊巴比妥钠(40 ~ 60 mg/kg)腹腔注射麻醉,固定于脑立体定位仪,颅顶备皮,常规碘酒消毒。至两侧眼眶之间向后沿颅骨中线切开颅顶皮肤约1 cm,钝性分离皮下组织至颅骨外膜,反复用棉球擦拭切口,防止出血。充分显露矢状缝与冠状缝,暴露前囟( bregma)。参照大鼠脑图谱[6],以前囟为始点,向后0.9 mm,中线左﹑右1.5 mm处在颅骨表面用印度墨水做标记点;用牙科电钻在标记点垂直颅骨表面进行打孔,开直径1 mm的骨窗,将微量注射器固定于脑立体定位仪的注射器夹持器上,垂直颅骨表面进针3.5 mm( 以颅骨外表面为基点)。5 min 内缓慢注入5 μL Aβ1-42(2 μg/μL),留针5 min 使其充分扩散,最后缓慢撤出注射器,对侧进行相同操作。注射完毕后,松弛注射器夹持器螺母旋钮,将动物从定位仪上撤下。手术全程动物体温维持在36℃~ 37 ℃,动物于麻醉清醒前单独放置。动物造模完成后,回笼饲
养7 d 后鉴定模型制备是否成功。AD模型大鼠制备标准参照Christensen 等[7] 相关文献报道。
1.2.3 蛋白标本、组织切片的存取和制备 全程实验结束后,动物腹膜腔注射常规麻醉。各组半数动物断头取脑,拨取海马冻存于超低温冰箱以备后用。半数动物剪开胸腔暴露心,将注射器针头从心尖部刺入左心室,用剪刀快速剪开右心耳;随后无菌生理盐水灌注,4 %多聚甲醛进行前固定,等待固定效果满意后终止灌注;断头开颅取脑并用4 %多聚甲醛后固定24 h。修剪大脑组织块,选取上丘平面至视交叉的节段,常规脱水、透明、石蜡包埋。石
蜡组织行冠状切片,制备片厚 5 μm的组织切片用于尼氏染色和免疫组织化学显色。
1.3 Morris水迷宫测试( Morris water maze test,MWM test)定位航行实验历时5 d,每天训练4 次。记录动物定位航行实验的逃避潜伏期、上台前路程及平均游泳速度。第6 天进行空间探索实验,记录动物120 s 内穿越平台的次数及在平台所在象限停留的时间百分比等指标。
1.4 尼氏染色及细胞计数
各组选取相同海马CA1区截面的切片进行尼氏染色。每张切片在CA1区随机选取3 个视野(200倍),计数1 mm长度内完整锥体细胞的个数,取其均数进行分析。
1.5 免疫组织化学显色
切片脱蜡至水,3 %过氧化氢孵育5 ~10 min, 消除内源性过氧化物酶活性, 蒸馏水洗5 min×3 次, 高压微波抗原热修复,PBS洗5 min×3 次,10 %山羊血清室温封闭30 min,滴加多克隆兔抗突触素( synaptophysin,SYN),4℃过夜,PBS洗5 min×3 次,滴加生物素标记的二抗,37 ℃ 孵育2 h,PBS洗5 min×3 次, 滴加辣根过氧化物酶标记的链霉卵白素,PBS洗5 min×3 次,DAB显色2 min,自来水洗,苏木精复染,上行梯度乙醇脱水,二甲苯透明,封片。
1.6 酶联免疫吸附试验( ELISA)各组动物实验全部结束后,10 % 水合氯醛(0.35mL/100 g)溶液经腹膜腔注射麻醉。用一次性注射器从动物尾静脉抽取1 mL全血留置于EP 管中,放入冰盒。随后低温离心机4 ℃离心15 min(5 000r/min),取血清100 μL 备用。检测血清超氧化物歧化酶( superoxide dismutase,SOD) 和谷胱甘肽过氧化物酶( glutathione peroxidase,GSH-Px)活性、丙二醛( malondialdehyde,MDA) 的含量。
ELISA 操作步骤根据制造商试剂盒说明书( 南京建成生物技术公司)进行。
1.7 免疫印迹检测
从超低温冰箱中取出冻存的脑组织,称重后放入EP管中并加入蛋白裂解液,冰浴环境下超声波破碎蛋白数次。低温超速离心机离心15 min,提取蛋白并测定蛋白浓度,将剩余的蛋白按每100 μL样品蛋白加入33.3 μL 4×上样Buffer 后振荡器混匀,置于沸水中变性10 min 备用。配制浓缩胶和分离胶,蛋白上样并进行电泳;浓缩胶恒压80 V 电泳,根据膜的面积大小计算转膜电压,恒压湿转约60 min ;5 %脱脂奶粉室温封闭1 h 后进行漂洗;SYN一抗(1 ∶ 3 000)4 ℃冰箱摇床缓慢过夜,次日取出T-TBS液漂洗;加入二抗室温避光孵育1 h 后避光漂洗;使用成像分析系统对条带进行统计分析。
1.8 图像处理和统计学处理
各组选取相同海马截面进行图像分析,每张切片在CA1区随机选取3个视野(200 倍) 计数1 mm长度内正常锥体细胞数,取均数分析。免疫组织化学显色结果用IPP 7.0 图像分析软件进行光密度测定。实验数据采用SPSS 18.0 软件进行分析,多样本均数比较采用单因素方差分析( one-wayANOVA),两两比较采用SNK-q 检验;多样本率的两两比较采用χ2 分割法( partitions of χ2 method)。
2 结果
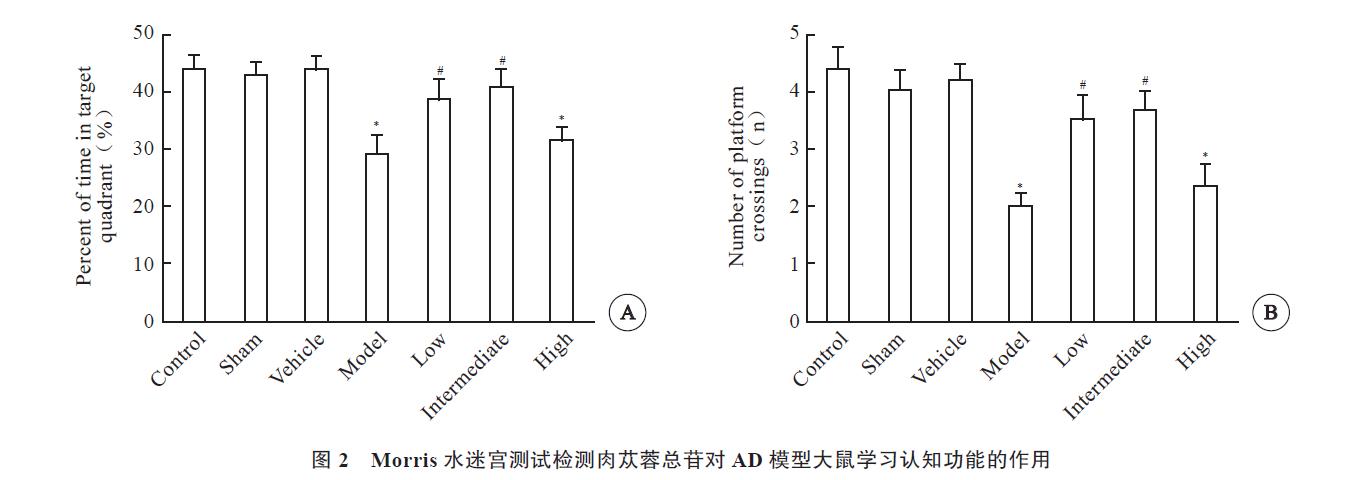
2.1 肉苁蓉总苷对AD模型大鼠学习认知功能的作用Morris 水迷宫定位航行实验结果显示,逃避潜伏期( P<0.05)与上台前路程( P<0.05)各组间存在显著性差异。随着实验时间的增加,逃避潜伏期与上台前路程均逐渐缩短,溶剂对照组、假手术组与空白对照组相比无差异;模型组逃避潜伏期、上台前路程较空白对照组明显增加( P<0.05);低剂量组、中剂量组逃避潜伏期、上台前路程均较模型组明显缩短( P<0.05),高剂量组与模型组无差异;平均游泳速度各组之间比较差异均无统计学意义( 图1,见封三)。空间探索实验结果显示,各组在目标象限的时间百分比差异存在统计学意义( P<0.05),而假手术组、溶剂对照组与空白对照组比较无差异,模
型组与空白对照组比较明显减小( P<0.05);与模型组相比,低剂量组、中剂量组在目标象限的时间百分比明显增加( P<0.05),高剂量组与模型组比较无差异。穿越平台次数组间差异存在统计学意义( P<0.05),而假手术组、溶剂对照组与空白对照组比较无差异,模型组与空白对照组比较穿越平台数明显减小( P<0.05);与模型组相比,低剂量组、中剂量组穿越平台数明显增加( P<0.05),高剂量组穿越平台数与模型组比较无差异( 图2)。
2.2 肉苁蓉总苷对AD模型大鼠死亡率的影响空白对照组、溶剂对照组与假手术组、模型组、低剂量组、中剂量组给药全程结束后,动物没有出现死亡现象;而高剂量组给药过程中出现动物肠胀气、死亡现象,死亡率为30.00 %,高剂量组死亡率与其他组比较差异有统计学意义( P<0.05)。
2.3 肉苁蓉总苷对AD模型大鼠海马CA1区正常锥体细胞数量的作用
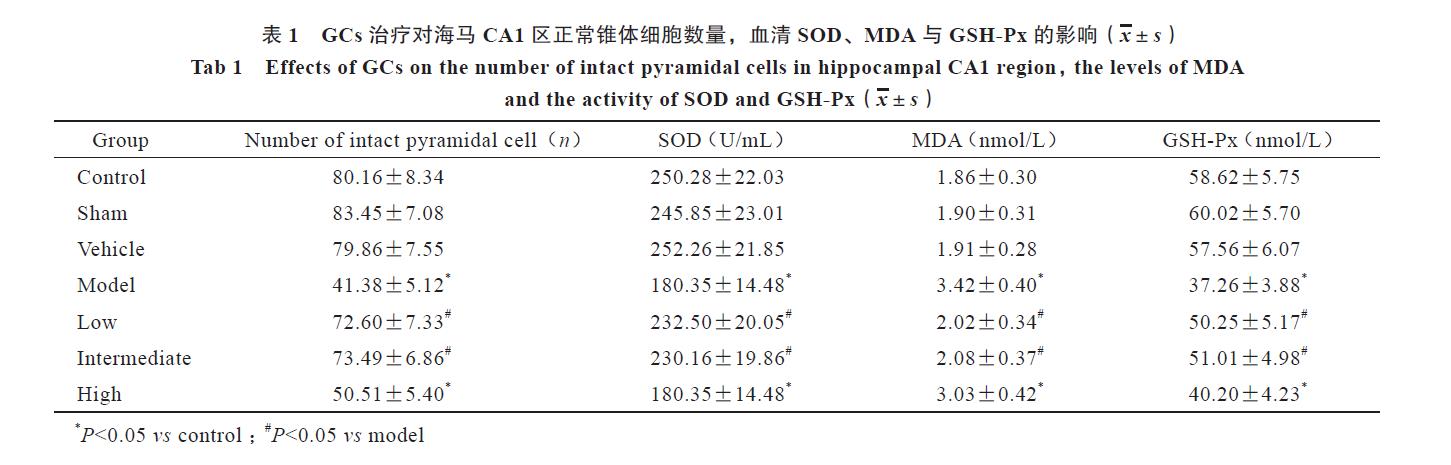
尼氏染色结果显示,模型组、高剂量组CA1区神经元减少,排列疏松紊乱,细胞形态大多异常、溶解坏死。低剂量组、中剂量组细胞形态规则、排列整齐、较致密,可见大量正常尼氏体,尼氏体呈紫色,核仁深染、清晰、居中,胞核不着色。空白对照组、溶剂对照组、假手术组细胞形态与低、中剂量组类似。海马CA1区锥体细胞计数显示,空白对照组、溶剂对照组、假手术组CA1区锥体细胞的数量最多,Aβ1-42 注射可以明显导致CA1区锥体细胞数量减少( P<0.05);给予模型大鼠GCs干预后,低剂量组、中剂量组CA1区锥体细胞数显著增加,与空白对照组比较无差异,而高剂量组与空白对照组比较差异有统计学意义( P<0.05)( 图3,见封三,表1)。
2.4 肉苁蓉总苷对AD模型大鼠突触相关蛋白表达的作用
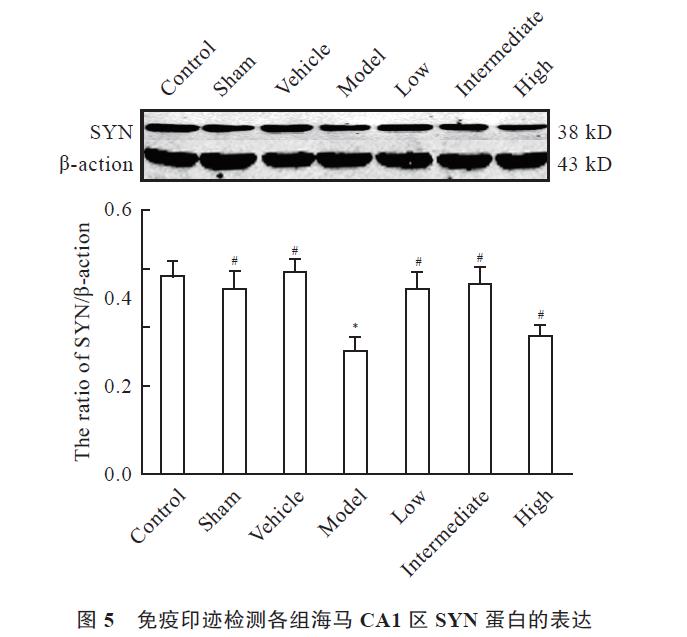
免疫组织化学结果显示,空白对照组、溶剂对照组与假手术组海马CA1区SYN阳性细胞数较多,Aβ1-42 注射可以使大鼠海马CA1区SYN阳性细胞数减少;体外GCs 补充治疗一定程度上可以增加海马CA1区SYN阳性细胞数,低剂量组、中剂量组作用较为显著,与空白对照组比较无显著性差异,但与模型组比较差异有统计学意义( P<0.05);高剂量组与模型组比较无差异( 图4,见封三)。免疫印迹结果显示,空白对照组、溶剂对照组与假手术组海马组织SYN蛋白表达量较多,Aβ1-42 注射可以使大鼠海马组织SYN蛋白表达量减少;体外GCs 补充治疗一定程度上可以增加海马组织SYN蛋白的表达,低剂量组、中剂量组作用较为显著,与空白对照组比较无差异,但与模型组比较差异存在统计学意义( P<0.05);高剂量组与模型组比较无差异( 图5)。
2.5 肉苁蓉总苷对AD模型大鼠氧化应激标志物的影响
空白对照组、溶剂对照组与假手术组血清SOD、GSH-Px 活性较高,MDA活性较低;与空白对照组比较,模型组血清SOD、GSH-Px 活性明显降低,MDA活性显著升高( P<0.05);给予GCs补充治疗后,低剂量组、中剂量组可以使模型大鼠血清SOD、GSH-Px 活性显著升高,MDA活性显著降低;上述指标与空白对照组比较无差异,但与模型组比较差异存在统计学意义( P<0.05);高剂量组与模型组上述检测指标比较无差异( 表1)
3 讨论
AD以学习认知功能障碍为主要临床表现,其主要的病理特征是胞外Aβ 沉积形成的老年斑和胞内神经原纤维缠结。Aβ 在细胞基质沉淀聚积可引起神经元细胞毒性及神经元纤维变性[8-9]。本实验采用双侧脑室可溶性Aβ1-42 寡聚体注射制备AD大鼠模型,Morris 水迷宫实验结果显示AD模型大鼠学习认知功能显著降低,提示Aβ 对学习认知功能具有明显的损害作用,该结果与既往报道相一致[10]。在正常老化过程中,神经元间信息传递的特化结构——突触的数量及完整性出现了不同程度的下降。突触是神经信息传递的关键部位,故突触的病理改变被认为是AD学习认知功能障碍的神经生物学基础[11]。突触可塑性的降低是AD学习认知功能障碍的主要发病因素之一。既往文献报道,Aβ 可诱导突触结构异常和功能失调,进而导致突触可塑性明显下降,故Aβ 可能是引起AD学习认知功能障碍的最主要的发病因素[12-13]。研究显示,GCs 具有改善AD相关学习认知功能障碍的药理作用[3-4] ;
文献报道显示,肉苁蓉提取物可以通过阻止Aβ 的沉积改善AD模型大鼠认知缺陷,并且可以提高海马多巴胺能神经元功能[14]。笔者的前期研究显示,GCs 治疗可以明显改善快速老化小鼠的学习认知功能障碍,提高树突棘的数量与突触蛋白的表达,并可以减少Aβ 的沉积,推测GCs 可能是通过阻止Aβ的沉积,进而降低对突触可塑性的损害来改善AD模型大鼠学习认知功能障碍,但GCs 通过何种机制改善突触可塑性说法不一。
AD的发病机制尚未阐明,自由基堆积、细胞凋亡、突触功能的损害为目前较为公认的衰老学说[3]。既往研究证明,GCs 可以明显改善AD模型大鼠的空间学习记忆能力[3],GCs 能显著增加快速老化小鼠海马CA1区锥体细胞数量、突触蛋白SYN与PSD-95 蛋白的表达量,同时可以增加对氧化自由基的清除,故推测GCs 改善AD相关空间学习记忆能力损害可能是通过抗氧化自由基损害,清除自由基堆积,进而提高突触可塑性从而提高学习记忆能力
和认知功能[15-17]。本研究结果显示GCs 可以提高海马CA1区正常锥体细胞的数量以及细胞形态,表明GCs 能显著提高细胞的存活率。此外,GCs 明显增加了海马组织树突棘的数量与SYN蛋白的表达,表明GCs提高了突触可塑性,GCs改善AD模型大鼠学习认知功能损害可能与提高突触可塑性相关。既往研究显示,GCs 具有抗氧化、抗衰老、清除自由基等功效[18-19]。龚梦鹃等[20] 用不同剂量的肉苁蓉水煎液给阳虚证的小鼠灌胃,结果显示肉苁
蓉水煎液可以降低丙二醛含量,升高超氧化物歧化酶以及谷胱甘肽过氧化物酶的活性;高占友等[21]报道肉苁蓉对大鼠产生的运动性疲劳有一定的延缓作用,并且对运动造成的脑组织中氧化损伤线粒体和脂质过氧化的程度具有抑制作用。古力努尔·木特列夫等[22] 的研究表明肉苁蓉中提取的松果菊苷( ECH)能够很好地抑制体外羟自由基、超氧阴离子自由基和脂自由基,提高GSH-px 和SOD活性,降低MDA含量,抑制单胺氧化酶( MAO)活性,
对D- 半乳糖所致的衰老引起的氧自由基损伤有一定的修复作用。
本实验研究结果显示,GCs 可以显著提高SOD和GSH-Px 活性,相反降低MDA的活性;能够增强自由基清除酶活性,增强机体对自由基的清除活力,减少自由基对机体的损伤,防止脂质过氧化作用,保护细胞免受损伤,进而提高细胞的存活率。此外,GCs 量效实验表明, 25 ~ 50 mg • kg - 1 • d - 1 的给药剂量改善模型大鼠的学习认知功能障碍的作用最为显著,高剂量组对学习认知功能几乎无改善作用。另外,在给药过程中,高剂量组容易引起动物肠胀气、死亡等现象,笔者推测可能是药物给药剂量过大,引起的毒性反应,故理想的给药剂量应该限制在50 mg • kg - 1 • d - 1 之内。今后的实验工作仍需要继续细化给药剂量,以期获得较为准确的给药剂量,避免药物的副作用以及动物、药物的浪费。综上所述,笔者认为GCs 改善AD相关学习认知功能障碍的机制可能是通过减少自由基堆积、清除体内过多的过氧化物,进而改善突触可塑性和提高细胞存活率来实现的,这将为GCs 用于临床预防和治疗AD奠定理论和实验基础。图版说明(图见封三)图 1 肉苁蓉总苷对AD 模型大鼠学习认知功能的作用。A :逃避潜伏期;B :上台前路程。*P<0.05 vs control ;#P<0.05 vsmodel.
图 3 肉苁蓉总苷对AD 模型大鼠海马CA1 区正常锥体细胞数量的作用,×200。 A :空白对照组;B :假手术组;C :溶剂对照组;D :模型组;E :低剂量组;F :中剂量组;G :高剂量组。红色箭头示海马锥体细胞发生核固缩和坏死.图 4 免疫组织化学检测各组海马CA1 区SYN 的表达,×200。A:空白对照组;B :假手术组;C :溶剂对照组;D :模型组;E :低剂量组;F :中剂量组;G :高剂量组。红色箭头示免
疫组织化学显色阳性细胞.
公司:win德赢官方
地址:新疆和田洛浦县杭桂路232号
公司网址:www.www.wagawa.com
厂家服务热线:0903-6682528
全国服务热线:400-966-8288
